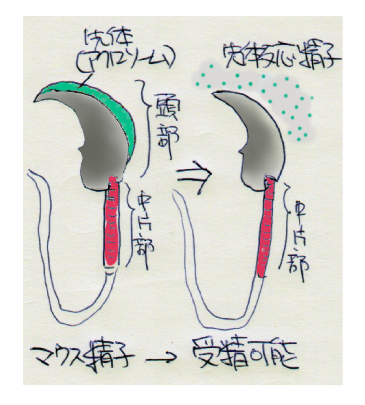
受精の研究では昔から抗体や酵素阻害剤などを体外受精の系に加えてその影響を見るという方法を使って受精関連因子が報告されてきました。ところが近年それら因子を持たない遺伝子改変マウスを作ってみると、不妊の症状が出ないものがほとんどという結果になりました。「再現性」という言葉を広義に解釈すると昔から研究が盛んに行われてきた有名な受精関連因子の重要性がKOマウスの系では再現されなかったということになります。
受精の分野に限らず、最近、論文のreproducibilityが驚くほど低いのではないかということが問題になっています。ほ乳類の受精のメカニズムの研究の歴史を振り返りながら再現性が取れない論文がどのようにして生まれてくるのかについて考察してみました。
精子はほとんど細胞質を持っていません。精子形成の過程で普通の細胞が持っているいろんなものを削ぎ落とし、染色体もプロタミンによって小さく折りたたまれ不活化されている特殊な細胞です。そんな精子ですが、他の細胞には見られない鞭毛を持っていたり頭の先端部分には酵素を含む大きな細胞小器官(アクロソーム)を持っています。鞭毛はもちろん精子が卵子に向かって泳いでゆくために必要ですが、それではアクロソームに含まれる酵素は何をしているのでしょう?
受精の研究が盛んになり始めたころに精子はアクロソームに含まれるアクロシンやヒアルロニダーゼなどの酵素群を放出する先体反応をおこさなければ受精できないことが報告されました。アクロソームに含まれる酵素類が受精のいろいろなステップに大切な役割を果たしているのではないかと考えるのは自然の成り行きです。
酵素の役割を確かめるために体外受精の系に酵素阻害剤などを添加すると受精が阻害されたので推論は証明されたと思われていました。似たような実験は精子に存在する精子特異膜表面タンパク質に対しても行われ様々な抗体に受精阻害作用が認められたので、これらの抗原は受精関連因子であると考えられました。これらの因子をめぐり受精研究は活況を呈し精子のcapacitationや先体反応(acrosome reaction)に関しても様々な報告がなされました。(総説 [1], [2])
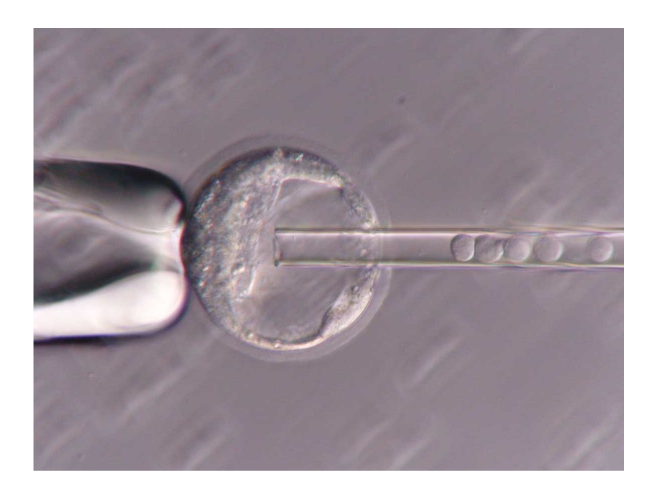
1988年にES細胞を利用したhomologous recombinationが報告されました[3]。様々な遺伝子がノックアウト(KO)され、何が起こるのかが確かめられるようになりました。
右の写真は遺伝子を組換えたES細胞をブラストシストに注入してキメラマウスを作製しているところです。現在ではCRISPRシステムを使うことでより簡単に遺伝子KOが可能になっています。
 受精の分野で一番最初にKOマウスを作ったのは筑波大学の馬場先生のグループでした。先体内酵素であるアクロシンのKOマウスが作製されたのですが[4]、多くの研究者の予想を裏切りマウスは不妊となりませんでした。馬場先生はマウスのアクロシン活性は他の種に比べて低いのではないかということと、マウスにはPRSS21というアクロシンに似た別の酵素も存在することが原因となり、マウスではアクロシンをKOしても不妊にならなかったのかもしれないと考えていました。ラットの場合はアクロシンが主なセリンプロテアーゼになっているので、私達はラットでアクロシンをKOしたのですが、アクロシンを欠失させてもラットが不妊になることはありませんでした[5]。
受精の分野で一番最初にKOマウスを作ったのは筑波大学の馬場先生のグループでした。先体内酵素であるアクロシンのKOマウスが作製されたのですが[4]、多くの研究者の予想を裏切りマウスは不妊となりませんでした。馬場先生はマウスのアクロシン活性は他の種に比べて低いのではないかということと、マウスにはPRSS21というアクロシンに似た別の酵素も存在することが原因となり、マウスではアクロシンをKOしても不妊にならなかったのかもしれないと考えていました。ラットの場合はアクロシンが主なセリンプロテアーゼになっているので、私達はラットでアクロシンをKOしたのですが、アクロシンを欠失させてもラットが不妊になることはありませんでした[5]。
また、卵子の周りに存在する卵丘細胞層を分散させるといわれていた酵素hyaluronidaseも受精に必要であろうと思われていたのですが、同じく馬場先生のラボで精子に2種類存在するヒアルロニダーゼ PH-20とHYAL5がKOされましたが、わずかに体外受精に遅延が認められるものの不妊のフェノタイプは検出されませんでした[6][45]。これら2種類のhyaluronidaseは遺伝子の存在部位が近いので交配によってダブルKOを作ることができませんが、なんとかしてダブルKOの場合の結果を知りたいものです。

アクロシンに代表されるように、これら様々な因子はそれぞれ受精に役割を持っているという様々な証拠があったにもかかわらずこのような結果になりました。なぜどのマウスも不妊にならなかったのでしょう?そこにはなにか理由が存在したにちがいありません。これら因子の役割を間違ったり過大評価した経緯を検証してみたいと思います
Richard DawkinsはThe Selfish Geneという本の中で、ヒトの心の中に誕生するいろんな考えなども遺伝子のように複製され、進化しながら生き延びる生き物のような性質を備えた存在であると言っています。彼はこれを生命と呼ぶ代わりに”ミーム(meme)”と名付けています[16]。Dawkinsの考えに従えば、研究者が提唱する「仮説」はミームと見なせます。ミームはウイルスのように増殖する性質を持っていると例えられることが多いのですが、私はミームには寄生虫のような性質も備わっていると思っています。
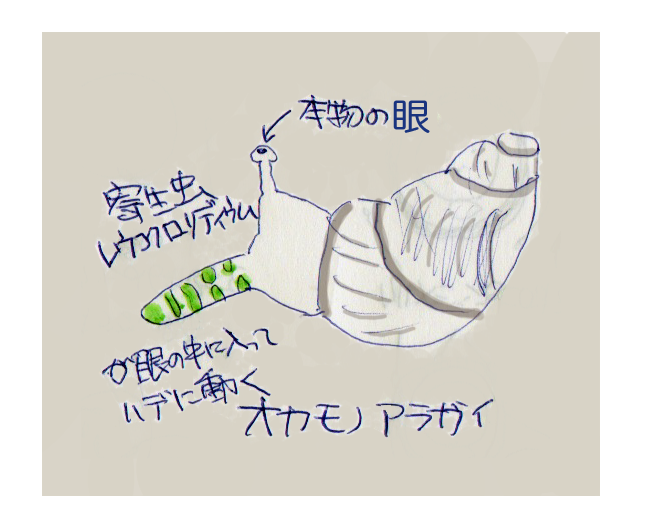 寄生虫に寄生された宿主は行動を寄生虫によって制御される例がたくさん知られています。たとえばカタツムリの一種であるオカモノアラガイにLeucochloridiumが寄生すると、この寄生虫のタマゴはカタツムリの体の中で派手な芋虫のようになってカタツムリの目の部分に入り込みます。その結果、決して引っ込まむことのないよく動く派手なツノのようになります。寄生された個体は本来、日陰に隠れて暮らしているのですが、ひなたにでてきて動き回るようになります。寄生虫によって行動が変化するわけです。その結果鳥に見つかりやすくなり鳥が芋虫と間違えてカタツムリの目玉をついばんで、この寄生虫は次の宿主である鳥に移行できるという風になっています。気持ち悪い動画なので、気の弱い人にはお薦めできませんがこの芋虫みたいな寄生虫はYouTubeの動画などで見ることができます。
寄生虫に寄生された宿主は行動を寄生虫によって制御される例がたくさん知られています。たとえばカタツムリの一種であるオカモノアラガイにLeucochloridiumが寄生すると、この寄生虫のタマゴはカタツムリの体の中で派手な芋虫のようになってカタツムリの目の部分に入り込みます。その結果、決して引っ込まむことのないよく動く派手なツノのようになります。寄生された個体は本来、日陰に隠れて暮らしているのですが、ひなたにでてきて動き回るようになります。寄生虫によって行動が変化するわけです。その結果鳥に見つかりやすくなり鳥が芋虫と間違えてカタツムリの目玉をついばんで、この寄生虫は次の宿主である鳥に移行できるという風になっています。気持ち悪い動画なので、気の弱い人にはお薦めできませんがこの芋虫みたいな寄生虫はYouTubeの動画などで見ることができます。
Selfish geneの考え方に立つと個体は遺伝子にとっては単なる乗り物のようなもので、その乗り物が仮に廃棄されることになってもその遺伝子が全体として増殖できるのなら遺伝子はその方向に進化するということになります。「仮説」(ミーム)の側から見ると研究者は自らを創出してくれた「創造主」にあたるはずですが仮説はselfish geneが振る舞うのと同じように「創造主」に敬意を払うどころか、自らを生み出した創造主の都合にはお構いなく、自らが広く伝播・増殖することだけを目指して研究者の行動を支配してしまうように見えます。ミームが人間をコントロールする力は極めて強力で、もしも相容れない2つの仮説が寄生したヒト同士が出会うと、仮説は自分の生き残りをかけて争いますがミームは体をもたないので寄生している人間を使った代理戦争を始めます。例えば天動説に寄生された研究者は地動説が寄生しているガリレオ・ガリレイの命を奪おうとしたりするわけです。ですからミームが自分の生存に適さないデータを研究者の意識から遠ざけたり、都合の良いデータを意識に残りやすくさせたりするのは簡単に違いありません。
 精子表面に存在するタンパク質であるfertilin[9]はMolecular biology of the cells(MBOC)の第4版には精子の融合タンパク質として大きく図が出ていたのですが、KOマウスの系を使ってFertilinなしの精子を作っても産子数に影響は出ないことが証明された[17]ので第5版のMBOCの教科書ではこの部分の記述は削除されました。この版には図の左側にある透明帯誘導先体反応仮説は残っていたのですが、これも最近の研究でほぼ否定されたので第6版では削除になりました。というか、大変悲しいことに第6版から受精のメカニズムの項そのものがなくなってしまいました。新たな図式で再度MBOCに受精の項を復活させたいものです!
精子表面に存在するタンパク質であるfertilin[9]はMolecular biology of the cells(MBOC)の第4版には精子の融合タンパク質として大きく図が出ていたのですが、KOマウスの系を使ってFertilinなしの精子を作っても産子数に影響は出ないことが証明された[17]ので第5版のMBOCの教科書ではこの部分の記述は削除されました。この版には図の左側にある透明帯誘導先体反応仮説は残っていたのですが、これも最近の研究でほぼ否定されたので第6版では削除になりました。というか、大変悲しいことに第6版から受精のメカニズムの項そのものがなくなってしまいました。新たな図式で再度MBOCに受精の項を復活させたいものです!
(ところでWikipediaにはいまだに先体反応は透明帯によって引き起こされると書かれています。)
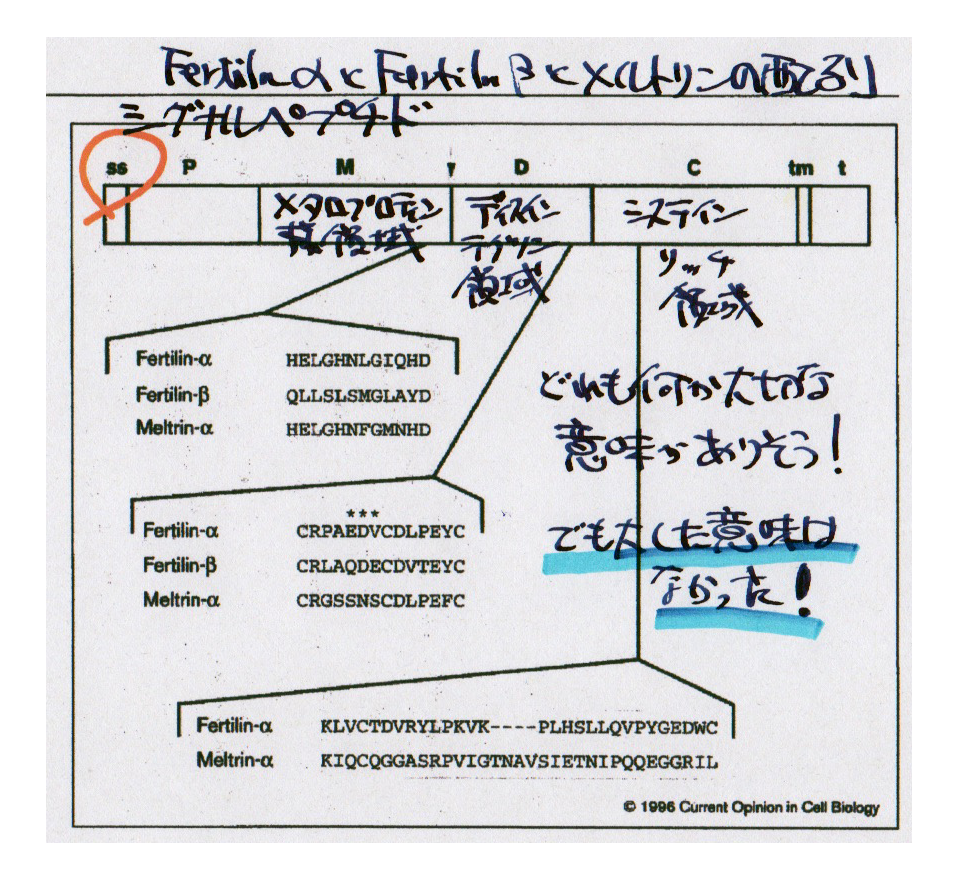
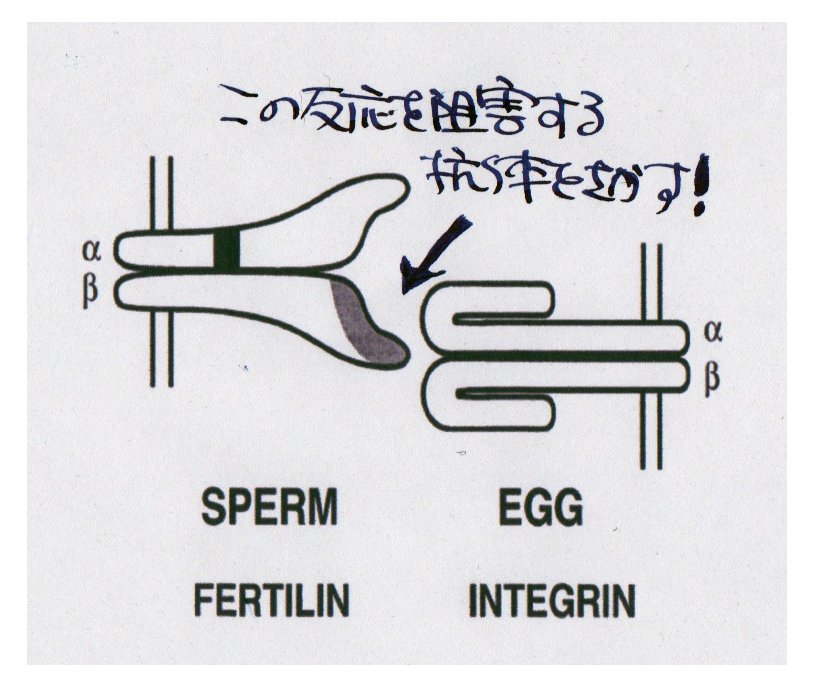 さて、Fertilin仮説が広く信じられていた頃には、Fertilinと結合する卵子上のカウンターパートが探索されました。Fertilinの構造の中にはディスインテグリン・ドメインと呼ばれるインテグリンと結合すると思われる配列が存在するのでFertilinは卵子のインテグリンと結合するのでないかと思われていました。別の表現をすると、そういうミームが誕生したのです。Fertilinはalpha/betaの2つのサブユニットからできています。サブユニットの名前は最近ADAMと呼ばれることが多くなりFertilinはADAM1b/ADAM2ということになります。
さて、Fertilin仮説が広く信じられていた頃には、Fertilinと結合する卵子上のカウンターパートが探索されました。Fertilinの構造の中にはディスインテグリン・ドメインと呼ばれるインテグリンと結合すると思われる配列が存在するのでFertilinは卵子のインテグリンと結合するのでないかと思われていました。別の表現をすると、そういうミームが誕生したのです。Fertilinはalpha/betaの2つのサブユニットからできています。サブユニットの名前は最近ADAMと呼ばれることが多くなりFertilinはADAM1b/ADAM2ということになります。
 インテグリンはダイマーとして存在するタンパク質で、いろいろなモノマーの組み合わせで組織特異的に発現をしています。卵子上のインテグリンが調べられインテグリン抗体による受精阻害作用が調べられました。そうすると[A]に示されるようにGoH3と名付けられたIntegrin alpha6抗体が精子と卵子との結合を特異的に阻害することが見つかったのです![18]。
インテグリンはダイマーとして存在するタンパク質で、いろいろなモノマーの組み合わせで組織特異的に発現をしています。卵子上のインテグリンが調べられインテグリン抗体による受精阻害作用が調べられました。そうすると[A]に示されるようにGoH3と名付けられたIntegrin alpha6抗体が精子と卵子との結合を特異的に阻害することが見つかったのです![18]。
Fertilinは受精に関与していないのににもかかわらずFertilinに対応する卵子上の因子としてIntegrin alpha6が浮かび上がったのです。まさに「たたけよさらば開かれん」ということが起こったわけです。でも20年以上まえのこの論文を読み返すと"Despite its potent inhibition of sperm binding, GoH3 did not inhibit fusion per se.”と書かれています。要するにIntegrin alpha6抗体は精子と卵子の結合を阻害するが融合には影響しないということです。ところがその後ろに続けて”Fusion was only inhibited when GoH3 reduced sperm binding to, on average, less than one sperm per egg”と但し書きが添えられています。精子の結合が一匹以下になる濃度というのは400マイクログラム/mlです。Mabを例外的ともいえるこんな高濃度に加えたときにはじめて融合が阻害されたようなのですが、この異常な高濃度の結果部分が論文の結論に仕上っているのはミームの為せる技だったのかもしれません。冷静にデータを読んでいれば精子と卵子の融合にインテグリンは大した機能は果たしていないという正反対の結論に到達できたのではないかと思われます。
integrin alpha6 が卵子の受精関連因子であるというこの論文が出たあとその役割を検証するためにintegrin alpha6を欠損させた卵子が作成されたのですが、受精能には影響が見られませんでした。従ってIntegrin alpha6仮説は成り立たないことが分かった[29]のです。その後さらにfertilinを持たない精子でも正常に受精することが示され[15]Fertilin仮説も消えることになりました。
 ミームは遺伝子と同じようにときに変異しながら増殖すると言われています。それに合致する例を紹介しておきます。筋肉の形成にも筋原線維の融合というステップが含まれるのでFertilinが融合に関わるという論文を読んだ人が筋肉でも同じようなことがおこっているのではないかと考え筋肉を調べるとFertilinと似た構造をもつメルトリンと呼ばれるタンパク質が発現していることを見つけたのです。そこでアンチセンスRNAを投与するとmyotubeの形成が有意に低下したので、メルトリンは筋肉の融合に関わっていると報告がなされました[19]。ミーム「Fertilin仮説」の変異体と言えます。その後meltrinをKOしても筋肉に重大な異常が見られず、meltrinKOの影響はむしろ脂質細胞の異常や原因不明の胎生致死として現れたのでmeltrin仮説も的を射てはいなかったということになります[20]。ここで注目すべきなのはアンチセンスRNAを投与してmyotubeの形成が阻害されたりインテグリン抗体で精子の結合が阻害されたりするというデータそのものが間違っていたわけではないだろうと言うことです。いずれも「有意に低下する」というデータを過大に解釈した(ミームの影響によって?)ことが幻の「インテグリン結合仮説」や「メルトリン融合仮説」を生むことにつながったのではないかと思うのです。
ミームは遺伝子と同じようにときに変異しながら増殖すると言われています。それに合致する例を紹介しておきます。筋肉の形成にも筋原線維の融合というステップが含まれるのでFertilinが融合に関わるという論文を読んだ人が筋肉でも同じようなことがおこっているのではないかと考え筋肉を調べるとFertilinと似た構造をもつメルトリンと呼ばれるタンパク質が発現していることを見つけたのです。そこでアンチセンスRNAを投与するとmyotubeの形成が有意に低下したので、メルトリンは筋肉の融合に関わっていると報告がなされました[19]。ミーム「Fertilin仮説」の変異体と言えます。その後meltrinをKOしても筋肉に重大な異常が見られず、meltrinKOの影響はむしろ脂質細胞の異常や原因不明の胎生致死として現れたのでmeltrin仮説も的を射てはいなかったということになります[20]。ここで注目すべきなのはアンチセンスRNAを投与してmyotubeの形成が阻害されたりインテグリン抗体で精子の結合が阻害されたりするというデータそのものが間違っていたわけではないだろうと言うことです。いずれも「有意に低下する」というデータを過大に解釈した(ミームの影響によって?)ことが幻の「インテグリン結合仮説」や「メルトリン融合仮説」を生むことにつながったのではないかと思うのです。
 先にミームは間違っているにもかかわらず、ミームが正しいことを支持するかのようなデータが見つかった例を2つ示しましたがもう一つ別の例を挙げてます。
先にミームは間違っているにもかかわらず、ミームが正しいことを支持するかのようなデータが見つかった例を2つ示しましたがもう一つ別の例を挙げてます。
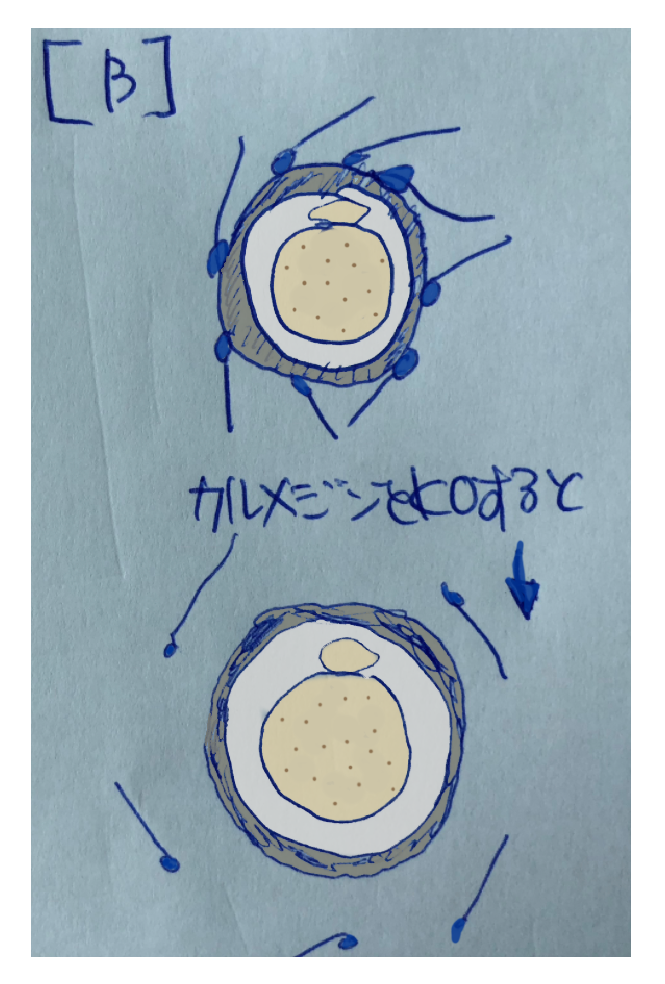
Calmeginという遺伝子は精巣内の生殖細胞に発現し、パキテン期のころからERに局在が見られるようになるタンパク質です。精子形成に何らかの働きを持っているだろうという予想で我々はKOマウスを作製したのですが、精子形成には影響が見られず、ガッカリしていたところ予期せず雄が不妊であることが見つかりました。原因を探るために体外受精の系で精子の挙動を見てみると卵子の透明帯に結合しないことがわかりました [30]。【B】はこの論文に載せた写真を模式図として示したものです。この頃は精子が透明帯に結合することにより先体反応が誘発されて精子が受精可能になるというミーム「透明帯誘導先体反応仮説」[22]が広く信じられていました。
【B】に示されるように精子が透明帯に結合できなくなるので、これが不妊の原因であろうと考えました。自然な推察なので多くの研究者に受け入れられ、我々の仮説は透明帯誘導先体反応仮説と共鳴しあってお互いを補完しながらそれぞれのミームが繁栄・増殖しました。
その後いろいろな遺伝子のKOが報告され、ACE(アンギオテンシン変換酵素)をKOすると精子が輸卵管に入ってゆかないというそれまで知られていなかったフェノタイプが報告されました。カルメジンKOマウスについてもACEKOと同じ方法で調べ直したところ輸卵管への移行に問題があることに気づきました。最初、私達の論文では輸卵管への移行は簡単な観察から"Motile sperm from -/- mice were present in the oviduct."と書いてしまったのですがこれは間違っていました。輸卵管を観察するときに子宮から輸卵管の方にコンタミしてきたものを輸卵管の中の精子と取り違えたと思います。(今は蛍光タンパク質で光る精子[24]で検討することができるのでこのようなミスを起こさないで済むようになっています。ADAM3をKOした著者らも精子は輸卵管に登ると間違った報告をしていました。我々はそのマウスを取り寄せて光る精子を用いた方法で確認するとやはり輸卵管に登らないのが本当であることがわかりました。)
 現在までに合計13種の遺伝子KOマウスがカルメジンやACEのKOのマウスとよく似たフェノタイプを示すことが知られています。即ち、これらのマウスが不妊になる直接の原因は精子が子宮から輸卵管に登ってゆかないためだったのです(総説: [15]) 。「透明帯結合能が受精能につながる」というミームはその後間違っていることがわかってきました。それは精子を直接輸卵管内に入れると透明帯に結合できない精子でも卵子を受精させる事ができたという実験結果が出たからです[23]。カルメジンの論文は自信をもって発表した論文でしたが、今ではミーム「透明帯誘導先体反応仮説」は教科書からは消え去り「透明帯結合能が受精能につながる」というミームも本質的な意味を持たないことがわかりました。我々の発表したKOマウスの根幹データは揺るがないのですが、その解釈として2つのミームがお互いを補完しあうという関係は消滅し、いまでは偶然そのように見えただけなのだということがわかったのです。偶然はその辺にいくらでも転がっており、ミームがあればいくらでも引き寄せられるものなのかもしれません!
現在までに合計13種の遺伝子KOマウスがカルメジンやACEのKOのマウスとよく似たフェノタイプを示すことが知られています。即ち、これらのマウスが不妊になる直接の原因は精子が子宮から輸卵管に登ってゆかないためだったのです(総説: [15]) 。「透明帯結合能が受精能につながる」というミームはその後間違っていることがわかってきました。それは精子を直接輸卵管内に入れると透明帯に結合できない精子でも卵子を受精させる事ができたという実験結果が出たからです[23]。カルメジンの論文は自信をもって発表した論文でしたが、今ではミーム「透明帯誘導先体反応仮説」は教科書からは消え去り「透明帯結合能が受精能につながる」というミームも本質的な意味を持たないことがわかりました。我々の発表したKOマウスの根幹データは揺るがないのですが、その解釈として2つのミームがお互いを補完しあうという関係は消滅し、いまでは偶然そのように見えただけなのだということがわかったのです。偶然はその辺にいくらでも転がっており、ミームがあればいくらでも引き寄せられるものなのかもしれません!
【別項】なぜ透明帯への結合能が輸卵管内への移行能と結びつくのか?
一般的に我々が仮説を立てるときに、その仮説が正しい割合はどのくらいと見積もれるのでしょうか2012年にNatureに掲載されたBegleyとEllisによるコメントによると、過去10年間に発表された53のpreclinical な領域での”landmark”的な論文の追試をカリフォルニアにあるAmgenという会社が行ったところ再現性が確認されたのは11%にとどまったそうです[31]。再現性を仮説の正しさと読み換えること、論文に提示された説の大半は正しくなかったということになります。再現性が取れない論文が驚くべき高率で存在するのは受精の分野に限らずガン研究の分野でも言えることのようです。あるいは心理学の分野でもかなり深刻な状態であるという報告があります。
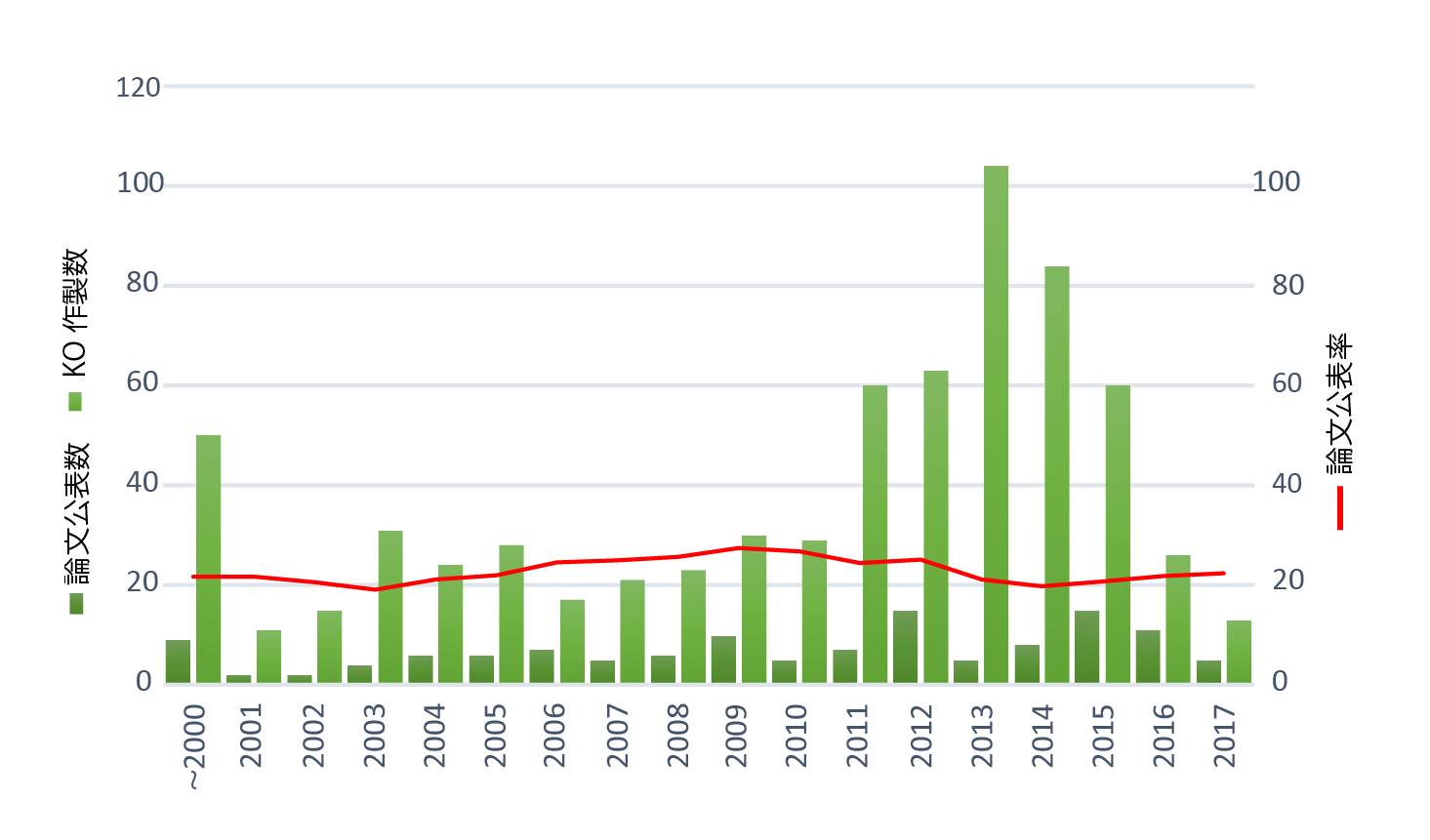 私は大阪大学でKOマウスの作製支援を1995年から2012年まで、あしかけ18年間担当し、様々な研究分野からの研究者と共に約400の遺伝子についてKOあるいはKIマウスの作製に関与してきました。実際のKOマウス作製の歴史は下のグラフに示されるようになっています。各年代を通じて論文になるものはだいたい2割程度しかありませんでした*。このKOにはいろんな分野のいろんなファクターの研究が含まれていますが、2割程度しか論文にできないということから遺伝子の機能を推定することがいかに難しいかが示されていると思われます。
私は大阪大学でKOマウスの作製支援を1995年から2012年まで、あしかけ18年間担当し、様々な研究分野からの研究者と共に約400の遺伝子についてKOあるいはKIマウスの作製に関与してきました。実際のKOマウス作製の歴史は下のグラフに示されるようになっています。各年代を通じて論文になるものはだいたい2割程度しかありませんでした*。このKOにはいろんな分野のいろんなファクターの研究が含まれていますが、2割程度しか論文にできないということから遺伝子の機能を推定することがいかに難しいかが示されていると思われます。
【* 注:KOマウスを作製してから実際に論文が出るまでに時間を要しますがこのグラフに示されている論文公表率とは大阪大学微生物病研究所内にあるNPO発生工学研究会のホームページにある各年度に公表されたKOマウスをその当該年度に作製された遺伝子改変動物数で割った値です。年代的に両者はズレるのですが約20年を通してほぼ一定の値を示しています。2013年に作製数が突然増加しているのはCRISPR法が現れたためです。】
この結果をみると遺伝子はすべて「大切な役割」を果たしているという解釈には疑問が生じます。それよりもパレートの法則やPower Lawと呼ばれる経験則が説くように、たとえば地震の大きさと頻度を順にならべると常に規模の大きい物ほど少なくなるというキレイな分布の偏りが生じるように、遺伝子の機能にもこのような偏りがあるのではないかと思われます。即ちパレートの法則風に表現すると「生体の8割の機能は2割の遺伝子の働きによって担われている。」という感じでしょうか?
 「アクロシンは精子に存在する特殊な細胞器官である先体(アクロソーム)にのみ発現される酵素であり、先体反応(アクロシンの放出)を起こさないと精子は受精可能にならず、アクロシンを阻害すると体外受精が阻害される。従ってアクロシンは受精に必須の酵素である。」疑いを差し挟む余地がないように見えたこの仮説も少なくともマウスやラットではこの「必須」という推察部分が正しくないことがKO実験で明らかになりました。アクロシンが必須であるというミームを生んだのはそこにしか存在しないという事実が働いたと思います。受精に必要であるといわれていた精子特異抗原の因子群も精子にしか存在しないという事実が即ち重要な働きをしているという認識に結びついたのではないかと思われます。
「アクロシンは精子に存在する特殊な細胞器官である先体(アクロソーム)にのみ発現される酵素であり、先体反応(アクロシンの放出)を起こさないと精子は受精可能にならず、アクロシンを阻害すると体外受精が阻害される。従ってアクロシンは受精に必須の酵素である。」疑いを差し挟む余地がないように見えたこの仮説も少なくともマウスやラットではこの「必須」という推察部分が正しくないことがKO実験で明らかになりました。アクロシンが必須であるというミームを生んだのはそこにしか存在しないという事実が働いたと思います。受精に必要であるといわれていた精子特異抗原の因子群も精子にしか存在しないという事実が即ち重要な働きをしているという認識に結びついたのではないかと思われます。
局在性のもつ意味が大したことがないのは明らかです。例えばヒトとマウスにおいて共通に保存され、しかも精巣でpredominatlyに発現する遺伝子のうち54種は、KOしても雄に特別の障害は認めらません[34]。すなわち「我々の体はよくできていて、ほとんど無駄のない仕組みで出来上がっている」という見方とは一致しません。たいした機能を持たない遺伝子がたくさん存在することこそが生命が新しい環境に対応した進化を遂げるために必要不可欠な存在となっているのではないでしょうか。
どう考えても疑いを差し挟む余地がないだろうというような仮説を含めてKOの記録を振り返ると8割の仮説は的外れと言っても差し支えないようなものだったのです。再びパレートの経験則を適用すると仮説のもつ本来の性質として2割の仮説は大きな意味をもつと言えるような気がします。
自分の持つ仮説が正しいかどうかはもちろん実験の結果がでるまで判断することができません。ただし仮説はミームとして働くので、ミームが自らの生存に不利な情報を選択的に遮断したり有利な情報を強調して記憶させたりするので仮説の誤りに気付くのはどうしても遅れがちになります。もし8割もの仮説が的外れ(?)になりうるとすると、我々は慎重の上にも慎重にミームに思考を乗っ取られないように注意しながら論文を記述する必要があります。
 トリを観察して「トリは卵を生むために巣作りをした」と記述したいこともあるかと思いますが、トリは排卵のことを全く念頭におかずに巣を作り、できた巣の刺激によって排卵が誘発されているのかもしれません。こんな場合は「トリは巣を作った後、排卵した」と表現すればいいのかもしれません。尤もこれだとレフリーにはdescriptiveといわれて論文がrejectされる危険性はありますが、それは大切な研究生活を間違いミームに捧げる危険を回避するためのコストと考えたほうがいいのかもしれません。//
トリを観察して「トリは卵を生むために巣作りをした」と記述したいこともあるかと思いますが、トリは排卵のことを全く念頭におかずに巣を作り、できた巣の刺激によって排卵が誘発されているのかもしれません。こんな場合は「トリは巣を作った後、排卵した」と表現すればいいのかもしれません。尤もこれだとレフリーにはdescriptiveといわれて論文がrejectされる危険性はありますが、それは大切な研究生活を間違いミームに捧げる危険を回避するためのコストと考えたほうがいいのかもしれません。//
この文章はこの文章はFEBS Lettersに発表した総説に手を加えて再編したものです。
科学はどんどん変化してゆくものです。この文章も新しい知見と合わなくなるかもしれません。また別のご意見もあるかと思います。そんな場合は(okabe◎biken.osaka-u.ac.jp)までお気軽にご意見をお寄せいただけると幸いです。 岡部 勝

1. Yanagimachi R. Mammalian Fertilization. New York: Raven Press, LTD.; 1994.
2. Okabe M. Sperm-egg interaction and fertilization: past, present, and future. Biol Reprod 2018.
3. Mansour SL, Thomas KR, Capecchi MR. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes. Nature 1988; 336:348-352.
4. Baba T, Azuma S, Kashiwabara S, Toyoda Y. Sperm from mice carrying a targeted mutation of the acrosin gene can penetrate the oocyte zona pellucida and effect fertilization. J Biol Chem 1994; 269:31845-31849.
5. Isotani A, Matsumura T, Ogawa M, Tanaka T, Yamagata K, Ikawa M, Okabe M. A delayed sperm penetration of cumulus layers by disruption of acrosin gene in rats. Biol Reprod 2017; 97:61-68.
6. Baba D, Kashiwabara SI, Honda A, Yamagata K, Wu Q, Ikawa M, Okabe M, Baba T. Mouse sperm lacking cell surface hyaluronidase PH-20 can pass through the layer of cumulus cells and fertilize the egg. Journal of Biological Chemistry 2002; 277:30310-30314.
7. Lu Q, Hasty P, Shur BD. Targeted mutation in beta1,4-galactosyltransferase leads to pituitary insufficiency and neonatal lethality. Dev Biol 1997; 181:257-267.
8. Asano M, Furukawa K, Kido M, Matsumoto S, Umesaki Y, Kochibe N, Iwakura Y. Growth retardation and early death of beta-1,4-galactosyltransferase knockout mice with augmented proliferation and abnormal differentiation of epithelial cells. EMBO J 1997; 16:1850-1857.
9. Blobel CP, Wolfsberg TG, Turck CW, Myles DG, Primakoff P, White JM. A potential fusion peptide and an integrin ligand domain in a protein active in sperm-egg fusion. Nature 1992; 356:248-252.
10. Saling PM. Involvement of trypsin-like activity in binding of mouse spermatozoa to zonae pellucidae. Proc Natl Acad Sci U S A 1981; 78:6231-6235.
11. Rochwerger L, Cuasnicu PS. Redistribution of a rat sperm epididymal glycoprotein after in vitro and in vivo capacitation. Mol Reprod Dev 1992; 31:34-41.
12. Hardy DM, Garbers DL. A sperm membrane protein that binds in a species-specific manner to the egg extracellular matrix is homologous to von Willebrand factor. J Biol Chem 1995; 270:26025-26028.
13. Hughes J, Ward CJ, Aspinwall R, Butler R, Harris PC. Identification of a human homologue of the sea urchin receptor for egg jelly: a polycystic kidney disease-like protein. Hum Mol Genet 1999; 8:543-549.
14. Bookbinder LH, Cheng A, Bleil JD. Tissue- and species-specific expression of sp56, a mouse sperm fertilization protein. Science 1995; 269:86-89.
15. Okabe M. Mechanisms of fertilization elucidated by gene-manipulated animals. Asian J Androl 2015; 17:646-652.
16. Dawkins R. The seflish gene. Oxford University Press; 1976: 224.
17. Kim E, Yamashita M, Nakanishi T, Park KE, Kimura M, Kashiwabara S, Baba T. Mouse sperm lacking ADAM1b/ADAM2 fertilin can fuse with the egg plasma membrane and effect fertilization. J Biol Chem 2006; 281:5634-5639.
18. Almeida EA, Huovila AP, Sutherland AE, Stephens LE, Calarco PG, Shaw LM, Mercurio AM, Sonnenberg A, Primakoff P, Myles DG, White JM. Mouse egg integrin alpha 6 beta 1 functions as a sperm receptor. Cell 1995; 81:1095-1104.
19. Yagami-Hiromasa T, Sato T, Kurisaki T, Kamijo K, Nabeshima Y, Fujisawa-Sehara A. A metalloprotease-disintegrin participating in myoblast fusion. Nature 1995; 377:652-656.
20. Kurisaki T, Masuda A, Sudo K, Sakagami J, Higashiyama S, Matsuda Y, Nagabukuro A, Tsuji A, Nabeshima Y, Asano M, Iwakura Y, Sehara-Fujisawa A. Phenotypic Analysis of Meltrin (ADAM12)-Deficient Mice: Involvement of Meltrin in Adipogenesis and Myogenesis. Molecular and Cellular Biology 2003; 23:55-61.
21. Ikawa M, Nakanishi T, Yamada S, Wada I, Kominami K, Tanaka H, Nozaki M, Nishimune Y, Okabe M. Calmegin is required for fertilin alpha/beta heterodimerization and sperm fertility. Developmental Biology 2001; 240:254-261.
22. Wassarman PM, Litscher ES. Mammalian fertilization: the egg's multifunctional zona pellucida. The International journal of developmental biology 2008; 52:665-676.
23. Tokuhiro K, Ikawa M, Benham AM, Okabe M. Protein disulfide isomerase homolog PDILT is required for quality control of sperm membrane protein ADAM3 and male infertility. Proceedings of the National Academy of Sciences of the United States of America 2012; 109:3850-3855.
24. Hasuwa H, Muro Y, Ikawa M, Kato N, Tsujimoto Y, Okabe M. Transgenic Mouse Sperm that Have Green Acrosome and Red Mitochondria Allow Visualization of Sperm and Their Acrosome Reaction in Vivo. Experimental Animals 2010; 59:105-107.
25. Muro Y, Hasuwa H, Isotani A, Miyata H, Yamagata K, Ikawa M, Yanagimachi R, Okabe M. Behavior of Mouse Spermatozoa in the Female Reproductive Tract from Soon after Mating to the Beginning of Fertilization. Biol Reprod 2016; 94:80.
26. La Spina FA, Puga Molina LC, Romarowski A, Vitale AM, Falzone TL, Krapf D, Hirohashi N, Buffone MG. Mouse sperm begin to undergo acrosomal exocytosis in the upper isthmus of the oviduct. Dev Biol 2016; 411:172-182.
27. Jin M, Fujiwara E, Kakiuchi Y, Okabe M, Satouh Y, Baba SA, Chiba K, Hirohashi N. Most fertilizing mouse spermatozoa begin their acrosome reaction before contact with the zona pellucida during in vitro fertilization. Proceedings of the National Academy of Sciences of the United States of America 2011; 108:4892-4896.
28. Hino T, Muro Y, Tamura-Nakano M, Okabe M, Tateno H, Yanagimachi R. The Behavior and Acrosomal Status of Mouse Spermatozoa In Vitro, and Within the Oviduct During Fertilization after Natural Mating. Biol Reprod 2016; 95:50.
29. Miller BJ, Georges-Labouesse E, Primakoff P, Myles DG. Normal fertilization occurs with eggs lacking the integrin alpha6beta1 and is CD9-dependent. J Cell Biol 2000; 149:1289-1296.
30. Ikawa M, Wada I, Kominami K, Watanabe D, Toshimori K, Nishimune Y, Okabe M. The putative chaperone calmegin is required for sperm fertility. Nature 1997; 387:607-611.
31. Begley CG, Ellis LM. Drug development: Raise standards for preclinical cancer research. Nature 2012; 483:531-533.
32. McNutt M. Reproducibility. Science 2014; 343:229.
33. Baker M, Penny D. Is there a reproducibility crisis? Nature 2016; 533:452.
34. Miyata H, Castaneda JM, Fujihara Y, Yu Z, Archambeault DR, Isotani A, Kiyozumi D, Kriseman ML, Mashiko D, Matsumura T, Matzuk RM, Mori M, et al. Genome engineering uncovers 54 evolutionarily conserved and testis-enriched genes that are not required for male fertility in mice. Proc Natl Acad Sci U S A 2016; 113:7704-7710.
35. Khan M, Jabeen N, Khan T, Hussain HMJ, Ali A, Khan R, Jiang L, Li T, Tao Q, Zhang X, Yin H, Yu C, et al. The evolutionarily conserved genes: Tex37, Ccdc73, Prss55 and Nxt2 are dispensable for fertility in mice. Scientific Reports 2018; 8.
36. Shang X, Shen C, Liu J, Tang L, Zhang H, Wang Y, Wu W, Chi J, Zhuang H, Fei J, Wang Z. Serine protease PRSS55 is crucial for male mouse fertility via affecting sperm migration and sperm-egg binding. Cell Mol Life Sci 2018.
37. Miyado K, Yamada G, Yamada S, Hasuwa H, Nakamura Y, Ryu F, Suzuki K, Kosai K, Inoue K, Ogura A, Okabe M, Mekada E. Requirement of CD9 on the egg plasma membrane for fertilization. Science 2000; 287:321-324.
38. Le Naour F, Rubinstein E, Jasmin C, Prenant M, Boucheix C. Severely reduced female fertility in CD9-deficient mice. Science 2000; 287:319-321.
39. Kaji K, Oda S, Shikano T, Ohnuki T, Uematsu Y, Sakagami J, Tada N, Miyazaki S, Kudo A. The gamete fusion process is defective in eggs of Cd9-deficient mice. Nat Genet 2000; 24:279-282.
40. Ducy P, Desbois C, Boyce B, Pinero G, Story B, Dunstan C, Smith E, Bonadio J, Goldstein S, Gundberg C, Bradley A, Karsenty G. Increased bone formation in osteocalcin-deficient mice. Nature 1996; 382:448-452.
41. Oury F, Khrimian L, Denny CA, Gardin A, Chamouni A, Goeden N, Huang YY, Lee H, Srinivas P, Gao XB, Suyama S, Langer T, et al. Maternal and offspring pools of osteocalcin influence brain development and functions. Cell 2013; 155:228-241.
42. Inoue N, Ikawa M, Isotani A, Okabe M. The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs. Nature 2005; 434:234-238.
43. Bianchi E, Doe B, Goulding D, Wright GJ. Juno is the egg Izumo receptor and is essential for mammalian fertilization. Nature 2014; 508:483-487.
44. Okabe M. The cell biology of mammalian fertilization. Development 2013; 140:4471-4479.
45. Kimura M, Kim E, Kang W, Yamashita M, Saigo M, Yamazaki T, Nakanishi T, Kashiwabara S, Baba T. Functional roles of mouse sperm hyaluronidases, HYAL5 and SPAM1, in fertilization. Biol Reprod 2009; 81:939-947.